 突破!国内首款 这家龙头公司旗下CAR-T细胞疗法获批临近
突破!国内首款 这家龙头公司旗下CAR-T细胞疗法获批临近 **《科创板日报》(上海,记者 徐红)讯 据《科创板日报》记者获悉,复星医药(600196.SH)旗下复星凯特CAR-T产品益基利仑赛注射液(代号FKC876,抗人CD19 CAR-T细胞注射液)目前已完成三合一审评。
根据新药审评流程,三合一审评结束后,仅剩国家药监局药品审评中心形成报告、递交国药监签字等手续。这意味着,这款CAR-T细胞治疗产品离获批仅一步之遥,有望成为国内首款上市CAR-T疗法。
益基利仑赛注射液即吉利德子公司Kite制药的抗人CD19 CAR-T细胞注射液(商品名Yescarta)。复星凯特从Kite Pharma引进Yescarta,获得其在中国的技术及商业化权利,并于中国境内(不包括港澳台地区)进行本地化生产。
2020年2月24日,复星医药曾发布公告,宣布FKC876的上市申请获国家药监局受理,用于治疗成人复发难治性大B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔 B 细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的 DLBCL。
截至目前,除了复星凯特的益基利仑赛注射液以外,药明巨诺的瑞基仑赛(研发代码为JWCAR029)亦已在2020年6月申报上市。这是继复星凯特之后,国内第二款申报上市的CAR-T细胞疗法。
同FKC876类似,JWCAR029是在美国巨诺公司旗舰产品JCAR017基础上,由药明巨诺自主开发的CAR-T产品,本次申报适应症预计为复发难治性B细胞非霍奇金淋巴瘤。
公开信息显示,迄今为止,全球共有三款已上市的CAR-T类免疫细胞治疗药物,其中诺华的Kymria和Kite公司的Yescarta均于2017年获批。之后,时隔近3年,FDA于2020年7月24日再次批准了一项新的CAR-T细胞疗法上市,即Kite公司的CD19 CAR-T细胞疗法Tecartus™(KTE-X19),用于治疗复发或难治性套细胞淋巴瘤(r/r MCL)。
值得指出的是,Kymria及Yescarta上市后,虽然两者的市场销售连年上升,但总的来说,并没有达到市场此前预期的“重磅炸弹药物”的目标。其中,Kite公司的Yescarta整体表现要好于诺华的Kymria。
市场分析认为,生产产能不足是限制销售的主要因素之一,而产能的差别也是导致这两款产品上市表现差异的重要原因。Yescarta在早期开发和申请上市过程中,产能问题相对解决得较好,因此拥有“先发”优势。
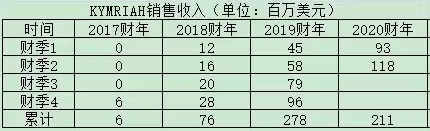

图|诺华Kymria和Kite公司的Yescarta上市后销售走势
与此同时,CAR-T产品高昂的价格将许多患者挡在了“门外”。以Kymriah和Yescarta为例,两者的售价分别高达47.3万美元和37.3万美元,折合人民币均在300万上下,而这仅仅是药品的价格,整个治疗的总费用还不止这些。
那么,益基利仑赛注射液获批上市后又会如何定价?对此,据《科创板日报》记者了解,目前复星凯特内部虽已有多个定价方案,但最终的定价仍待落定。“总体来说,由于成本较高,因此不会太便宜。”复星凯特相关高层表示。





